



▍ 导读
锂硫(Li-S)电池在实现超越锂离子电池的实用高能量密度方面前景广阔。贫电解质条件是实现高能量密度锂-硫电池的先决条件,但不可避免地会降低电池性能,特别的硫阴极动力学。
近日,北京理工大学黄佳琦教授、李博权副研究员等团队系统地分解了硫阴极的极化,以确定贫电解质Li-S电池的关键动力学限制因素。具体而言,作者开发了一种电化学阻抗谱结合电恒电流间歇滴定技术的方法,将阴极极化分解为活化、浓度和欧姆部分。其中,随着电解质硫比(E/S比)的降低,硫化锂成核过程中的活化极化成为主导极化,而缓慢的界面电荷转移动力学被认为是贫电解质条件下电池性能下降的主要原因。因此,提出了一种双(氟磺酰)亚胺锂电解质来降低活化极化,采用这种电解质的Li-S电池在0.2 C的低E/S比(4 μL mg-1)条件下可提供985 mAh g-1的放电容量。这项工作确定了贫电解质Li-S电池的关键动力学限制因素,为设计合理的促进策略以实现先进的Li-S电池提供了指导。
该成果发表在国际顶级期刊《J. Am. Chem. Soc.》上,第一作者是:Chen Zi-Xian。
▍ 研究背景
锂硫(Li-S)电池被认为是最有希望实现实际高能量密度的电池系统之一,因为其具有2600 Wh kg-1的超高理论能量密度。典型的锂硫电池采用元素硫作为阴极,金属锂作为阳极,并使用醚基电解质。在放电过程中,硫阴极从元素硫转化为硫化锂(Li2S)的过程遵循固-液-固反应机制,并依赖于可溶性多硫化锂(LiPS)的中间体。LiPSs避免了元素硫和Li2S之间直接固-固转化的巨大反应障碍,保证了Li-S电池的顺利能量传输。此外,含有LiPS的电解质能够通过化学歧化和配比反应来调节元素硫和Li2S的溶解和沉积的相变过程,这进一步促进了阴极动力学的发展。因此,LiPSs的动力学及其有效调节在很大程度上决定了Li-S电池的性能。
LiPSs溶解在电解液中,其电化学行为在很大程度上取决于电池工作条件下电解液中LiPSs的浓度所对应的电解液量。通常情况下,在过量的电解液(低LiPS浓度)条件下,硫的氧化还原动力学是相当有利的。高效的反应动力学保证了硫的高利用率和Li-S电池的出色的速率能力。尽管大量的电解液支持平稳的阴极动力学,但过多的电解液在实践中大大降低了可实现的能量密度。在电池设计中,电解质体积与硫质量比(E/S比)是决定实用Li-S电池可实现能量密度的关键参数。具体来说,当E/S比高于4μL mg-1时,很难实现400 Wh kg-1的Li-S软包电池。因此,过多的电解液大大降低了Li-S电池内在的高能量密度优势,而贫电解液条件对于实现实用的高能量密度Li-S电池至关重要。
不幸的是,在低电/液比条件下,硫阴极动力学变得极其迟缓,这导致了Li-S电池性能衰减,如放电容量减少和循环率有限。尽管性能有所提高,但对贫电解质条件下的硫阴极动力学的基本认识仍然不足,特别的导致性能下降的关键动力学限制因素。Chiang和他的同事指出,随着LiPSs浓度的增加,Li2S的沉积率下降,导致了巨大的阴极放电极化。此外,Manthiram和同事提出在低E/S比率下,Li2S的沉积动力学缓慢,这是由于在高LiPS浓度条件下LiPS集群的行为。另一方面,Huang和同事发现,含有高浓度LiPSs的电解液渗透性差,离子传导性低,导致贫电解液条件下阴极动力学迟缓。因此,贫电解质条件下硫阴极的关键动力学限制因素仍有争议。为了找到关键的动力学限制因素,指导合理的动力学促进策略设计和实际条件下的电池性能提升,非常需要全面的动力学分析。
本工作通过解耦工作条件下的动力学极化,系统地评估了阴极动力学,以确定贫电解质Li-S电池的关键动力学限制因素。开发了一种电化学阻抗谱结合恒电流间歇滴定技术(EIS-GITT)的方法,将放电过程中的总阴极极化(ηtotal)解耦为活化极化(ηac)、浓度极化(ηcon)和欧姆极化(ηohm)。随着E/S比的降低,Li2S成核过程提供了最高的ηohm,ηac被确定为这个阶段的主导极化,从而导致贫电解质Li-S电池的动力学迟缓和性能下降。为了解决上述问题,在贫电解质Li-S电池中采用了双(氟磺酰)亚胺锂(LiFSI)电解质来减少ηac。采用LiFSI电解质的Li-S电池在0.2C的高倍率下表现出典型的两平台充放电曲线,并在E/S比为4μL mg-1时获得了985 mAh g-1的放电容量,而对照电池的放电容量在大极化下低于200 mAh g-1。这项工作明确了迟缓的界面电荷转移动力学是贫电解质Li-S电池的关键动力学限制因素,并为在工作条件下促进贫电解质Li-S电池提供了合理的指导。
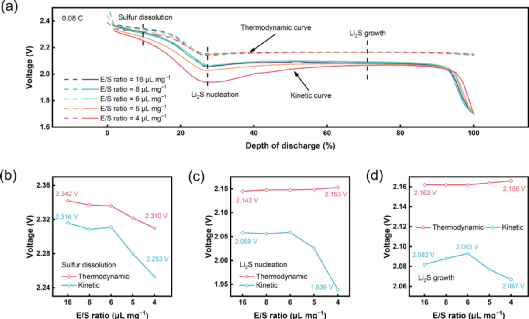
图1.放电过程中不同E/S比下硫阴极的热力学和动力学。(A)当E/S=16、8、6、5或4μL mg−1时,硫阴极的热力学和动力学曲线。当E/S比=16、8、6、5或4μL mg−1时,在(B)硫溶解阶段、(C)Li2S成核阶段和(D)Li2S生长阶段的热力学(红色)和动力学(蓝色)电压。
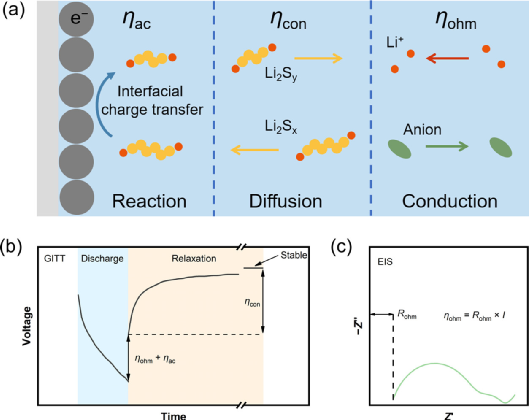
图2. EIS-GITT动力学极化解耦方法。(a) 关于界面电荷转移、反应物扩散(Li2Sx,6≤x,Li2Sy,4≤x≤6)和离子在电解液中传导的电极反应过程示意图,这些反应过程分别产生ηac、ηcon和ηohm。关于GITT (b)和(c) EIS测量的动力学极化解耦方法的机理。
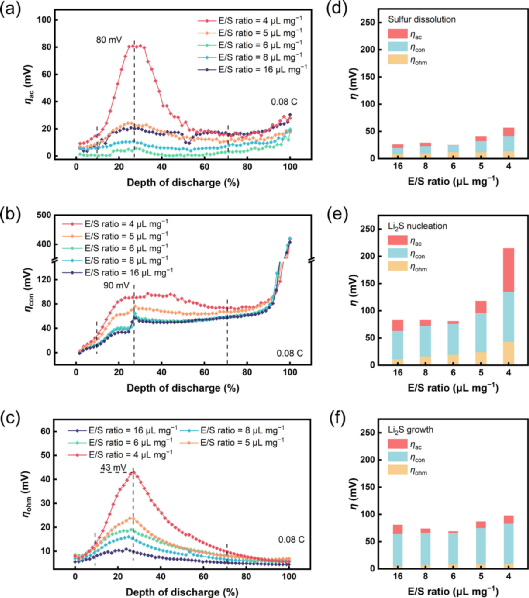
图3. 不同E/S比下的解耦阴极动能极化分析。(a) ηac, (b) ηcon, 和 (c) ηohm在E/S比=16, 8, 6, 5, 或 4 μL mg-1,0.08 C的放电过程中的演变。(d) 硫溶解阶段,(e) Li2S成核阶段,和(f) E/S比=16, 8, 6, 5, 或 4 μL mg-1的Li2S生长阶段的极化分析。
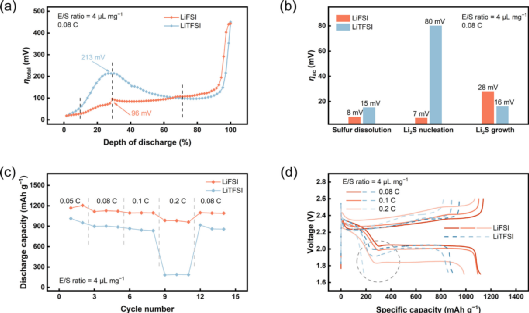
图4. 使用LiFSI电解质的贫电解质Li-S电池的动力学评估和电池性能。(a) 在0.08 C下,使用LiFSI电解质或LiTFSI电解质的贫电解质Li-S电池的总极化分析,(b) 硫溶解、Li2S成核和Li2S生长阶段的解耦活化极化。(c) E/S比=4μL mg-1时Li-S电池的速率性能;(d) 不同速率下相应的充放电曲线。
▍ 结论
总之,本工作通过解耦工作条件下的动力学极化,确定了贫电解质Li-S电池中硫阴极动力学的关键动力学限制因素。开发了一种EIS-GITT方法,将硫阴极的ηtotal解耦为放电过程中的ηac、ηcon和ηohm,并对不同E/S比条件下的阴极动力学进行了系统的评估。ηac被认为是Li2S成核阶段的关键动力学限制因素,主要导致贫电解质Li-S电池的动力学迟缓以及性能下降。为了解决上述问题,使用LiFSI锂盐来替代传统的LiTFSI,使用LiFSI的电解质有效地促进了贫电解质Li-S电池中迟缓的阴极动力学。使用LiFSI电解液的Li-S电池在整个放电过程中表现出大大降低的ηac,并在4μL mg-1的低E/S比和0.2 C的大电流密度下获得985 mAh g-1的放电容量。这项工作确定了LiPSs的界面电荷转移是关键的动力学限制过程,ηac是贫电解质Li-S电池的关键动力学限制因素。上述基本认识激发了对促进贫电解质Li-S电池的硫氧化还原动力学的合理和有针对性的策略设计,本文提出的EIS-GITT极化分解方法有助于了解实际工作条件下的电极过程。
Cathode Kinetics EvAluation in Lean-Electrolyte Lithium−Sulfur Batteries
Zi-Xian Chen, Qian Cheng, Xi-Yao Li, Zheng Li, Yun-Wei Song, Furong Sun, Meng Zhao, Xue-Qiang Zhang, Bo-Quan Li,* and Jia-Qi Huang* https://doi.org/10.1021/jacs.3c02786
文章来源:电化学能源
特别声明:本站所载图文内容均来源互联网,微信公众号等公开渠道,我们对文中观点保持中立,出于更直观传递信息之目的转载稿件,仅供参考。版权归原作者和机构所有,并不代表本网赞同其观点和对其真实性负责。如有侵权,或涉及任何第三方合法权利,请及时联系我们删除(微信:snan2109;QQ:906945059),我们会及时反馈并处理完毕。